POLARISABILITAS
Polarisabilitas
merupakan pergerakan elektron yang mengakibatkan dipol sesaat dalam suatu
molekul. Pergerakan atau
perpindahan elektron pada suatu atom dapat mengakibatkan tidak meratanya
kepadatan elektron pada atom, sehingga atom tersebut mempunyai satu sisi dipol dengan muatan lebih negatif
dibandingkan sisi yang lain. Pergerakan ini menimbulkan dipol sesaat. Gambar
dibawah ini menggambarkan perbedaan sebaran elektron pada orbital normal dan
orbital yang mengalami dipol sesaat. Adanya dipol sesaat menyebabkan molekul
yang bersifat non-polar menjadi bersifat agak polar.
Polarisabilitas ini merupakan kemudahan suatu molekul untuk membentuk dipol sesaat atau untuk
mengimbas suatu molekul. Polarisabilitas berkaitan dengan massa molekul relatif
(M r) dan bentuk molekul. Pada umumnya, makin banyak jumlah elektron dalam
molekul, makin mudah mengalami polarisasi. Oleh karena jumlah elektron
berkaitan dengan massa molekul relatif, maka dapat dikatakan bahwa makin besar
massa molekul relatif, makin kuat gaya London. Misalnya, radon (Ar = 222)
mempunyai titik didih lebih tinggi dibandingkan helium (Ar = 4), 221 K untuk Rn
dibandingkan dengan 4 K untuk He. Molekul yang bentuknya panj ang lebih mudah
mengalami polarisasi dibandingkan molekul yang kecil, kompak, dan simetris.
Misalnya, normal pentana mempunyai titik cair dan titik didih yang lebih tinggi
dibandingkan neopentana. Kedua zat itu mempunyai massa molekul relatif yang
sama besar.
Faktor-faktor yang mempengaruhi polarisabilitas
Hubungan antara
polarisabilitas dan faktor kerapatan elektron, jari-jari atom, dan orientasi
molekul adalah sebagai berikut:
1. Semakin besar jumlah elektron, kurang mengontrol muatan inti memiliki
distribusi muatan, dan dengan demikian polarisabilitas meningkat dari atom.
2. Semakin besar jarak elektron dari muatan inti, kurang mengontrol muatan
inti memiliki pada distribusi muatan, dan dengan demikian polarisabilitas
meningkat dari atom.
3. Orientasi molekul sehubungan dengan medan listrik dapat mempengaruhi
polarizibility (berlabel Orientasi-dependent), kecuali untuk molekul:
tetrahedral, oktahedral atau ikosahedral (berlabel Orientasi-independent). Faktor
ini lebih penting bagi molekul tak jenuh yang mengandung bidang elektron daerah
padat, seperti 2,4-heksadiena. Polarisabilitas terbesar dalam molekul ini
tercapai ketika medan listrik diterapkan sejajar dengan molekul daripada tegak
lurus terhadap molekul.
Polarisabilitas
memiliki simbol α dan satuan m³
Pergerakan
elektron yang mengakibatkan dipol sesaat dalam suatu molekul akan bertambah
besar apabila molekul tersebut memiliki jumlah elektron yang semakin besar
pula. Pergerakan elektron yang mengakibatkan dipol sesaat dalam suatu molekul
disebut polarisabilitas. Jumlah elektron yang besar berkaitan dengan massa
molekul relatif (Mr) molekul tersebut, sehingga semakin besar Mr suatu molekul,
maka semakin besar polarisabilitasnya dan semakin besar pula Gaya Londonnya.
Dipol sesaat pada suatu atom dapat
mengimbas atom yang berada di sekitarnya sehingga terjadilah dipol terimbas
yang menyebabkan gaya tarik-menarik antara dipol sesaat dengan dipol terimbas.
Gaya ini yang disebut sebagai Gaya
London.

Kekuatan gaya tarik London sebanding dengan
polarisabilitas molekul. Polarisabilitas menunjukkan kemudahan terganggunya
distribusi elektron dalam molekul. Pada umumnya, makin besar massa molar (M )
molekul yang berarti jumlah elektron makin banyak, polarisabilitas makin tinggi
(distribusi elektron semakin mudah terganggu) sehingga gaya London makin kuat.
Gaya London yang semakin kuat mengakibatkan titik didih
molekul semakin tinggi. Sebagai contoh, Anda bandingkan gaya tarik antarmolekul
CH4 (Mr=16 g/mol) dan
molekul C3H8 (Mr=
44). Molekul CH4 memiliki massa molar yang lebih besar dari C3H8.
Akibatnya gaya London dalam molekul ini lebih kuat sehingga titik didih
molekulnya juga lebih tinggi. Titik didih C3H8 adalah
-42°C, sedangkan titik didih CH4 adalah -161°C.
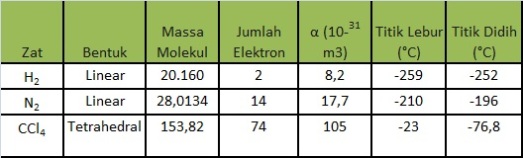
Contohnya yakni :
Molekul dengan struktur panjang
mempunyai kemungkinan lebih besar untuk mengalami dipol sesaat atau lebih mudah
mengalami polarisabilitas. Hal ini dikarenakan molekul dengan struktur panjang
mempunyai bidang yang lebih luas bila dibandingkan dengan molekul yang memiliki
struktur lebih rapat dan kecil. Neopentana dan normal pentana merupakan contoh
2 molekul dengan Mr sama. Lihatlah Gambar (a) dan (b) di bawah untuk mengetahui
bentuk molekulnya.
Adanya Gaya London antara molekul-molekul non
polar menyebabkan pada waktu peleburan dan pendidihan diperlukan sejumlah
energi untuk memperbesar jarak antara molekul-molekul non polar. Semakin kuat
Gaya London antar molekul-molekul, semakin besar pula energi yang digunakan
untuk terjadinya peleburan dan pendidihan.
Gaya London yang semakin kuat menyebabkan proses peleburan dan
pendidihan molekul-molekul yang terlibat dalam gaya tersebut memerlukan energi
yang besar untuk memperbesar jarak antarmolekul nonpolar.
DAFTAR PUSTAKA




